Wenn Prozesse das Haus verlassen – Transparenz behalten
In der Medizinprodukteindustrie ist die Auslagerung von Prozessen längst Normalität. Hersteller müssen sich auf ihre Kernkompetenzen konzentrieren, gleichzeitig aber sicherstellen, dass alle extern bezogenen Tätigkeiten dieselben hohen Qualitäts- und Compliance-Anforderungen erfüllen wie interne Prozesse. Die EN ISO 13485:2021 bildet auch hierfür einen Rahmen.
Prozesse im Lebenszyklus eines Medizinproduktes, die nicht vom Unternehmen selbst durchgeführt werden, sondern von einem externen Dienstleister oder einer anderen Organisation im Auftrag des Herstellers durchgeführt werden, sind auch als ausgelagerte Prozesse für die Produktqualität oder die Einhaltung regulatorischer Anforderungen relevant.
Jedoch nicht jeder externe Dienstleister bedeutet automatisch einen ausgelagerten Prozess. Ein Prozess ist dann ausgelagert, wenn sein Ergebnis direkt oder indirekt die Qualität des Produkts oder die Erfüllung regulatorischer Anforderungen beeinflusst.
Als Hersteller sind Sie verpflichtet, ausgelagerte Prozesse ebenso kontrolliert und dokumentiert zu führen wie interne Abläufe. Denn Sie als Hersteller tragen zu jedem Zeitpunkt die volle Verantwortung für die Qualität und Konformität ihrer Medizinprodukte.
Mit diesem Artikel zeigen wir Ihnen, welche klassischen und kritischen Prozesse typischerweise ausgelagert werden, wie sie sich in der Wertschöpfungskette verorten lassen und was sie als Hersteller dabei über den gesamten Produktlebenszyklus hinweg beachten müssen.
Verortung ausgelagerter Prozesse in der EN ISO 13485
Die ISO 13485 definiert ausgelagerte Prozesse als Tätigkeiten, die ein Hersteller zur Erfüllung regulatorischer und kundenseitiger Anforderungen benötigt, die aber nicht intern durchgeführt, sondern von einem externen Anbieter übernommen werden. Die Norm verpflichtet Hersteller dazu, diese Prozesse genauso zu kontrollieren wie interne Abläufe. Die Verantwortung bleibt beim Hersteller – immer.
In der EN ISO 13485:2021 beschreibt der Abschnitt 4.1.5 die Verantwortung des Herstellers im Zusammenhang mit ausgelagerten Prozessen und stellt mit ihm eine zentrale Anforderung an das Qualitätsmanagementsystem dar. Wenn ein Hersteller Prozesse an externe Organisationen überträgt, die einen Einfluss auf die Produktkonformität oder die Erfüllung regulatorischer Anforderungen haben, bleibt die Verantwortung für deren Wirksamkeit und Einhaltung vollständig beim Hersteller. Eine Auslagerung entbindet ihn also nicht von der Pflicht, sicherzustellen, dass die betreffenden Prozesse jederzeit unter angemessener Kontrolle stehen.
Um diese Kontrolle zu gewährleisten, fordert sowohl die EN ISO 13485 als auch die MDR, dass der Hersteller geeignete Maßnahmen und objektive Nachweise zur Steuerung ausgelagerter Prozesse etabliert. Dazu gehören beispielsweise vertragliche Vereinbarungen, die Verantwortlichkeiten und Qualitätsanforderungen klar regeln (EN ISO 13485:2021, Abschnitt 4.1.5; MDR Art. 10 Abs. 9 und Anhang IX, Kapitel I).
Weiterhin ist eine systematische Qualifizierung, Auswahl, Bewertung und Überwachung von Lieferanten und Dienstleistern erforderlich, um sicherzustellen, dass diese dauerhaft in der Lage sind, die spezifizierten Anforderungen zu erfüllen (ISO 13485:2021, Abschnitt 7.4.1 und 7.4.3; MDR Art. 10 Abs. 9).
Als wesentliche Instrumente zur Überwachung ausgelagerter Prozesse nennt die Norm unter anderem Audits, regelmäßige Leistungsbewertungen, sowie technische Abnahmen und Prüfungen der gelieferten Produkte oder Dienstleistungen (ISO 13485:2021, Abschnitt 7.4.3 sowie 8.4). Die MDR ergänzt diese Anforderungen durch die Verpflichtung, ausgelagerte Tätigkeiten in das Qualitätsmanagementsystem, die Post-Market-Surveillance und gegebenenfalls in die Vigilanzprozesse einzubinden, sodass die Einhaltung der Sicherheits- und Leistungsanforderungen über den gesamten Produktlebenszyklus hinweg gewährleistet ist (MDR Art. 10 Abs. 9, Art. 83–86).
Die Art und der Umfang dieser Kontrollen müssen dabei dem Risiko angepasst sein, das mit dem jeweiligen ausgelagerten Prozess verbunden ist. Prozesse mit hohem Einfluss auf die Produktqualität oder Patientensicherheit erfordern eine intensivere Überwachung als Tätigkeiten mit geringem Risiko.
Klassische Beispiele ausgelagerter Prozesse
Je nach Geschäftsmodell können Hersteller Teile oder sogar die gesamte Wertschöpfungskette auslagern. Dabei reicht das Spektrum von der Vergabe einzelner Fertigungsschritte bis hin zu umfassenden End-to-End-Dienstleistungen.
Durch die Einbindung externer Partner entstehen zusätzliche Schnittstellen, die klare Verantwortlichkeiten, dokumentierte Anforderungen und eine wirksame Lieferantenüberwachung erfordern. Gleichzeitig ermöglicht die Auslagerung Spezialwissen, Skalierbarkeit und Effizienzgewinne, bringt jedoch auch erhöhte regulatorische Anforderungen und Risiken mit sich, die sorgfältig gesteuert werden müssen.
Typischerweise lagern Hersteller ausgewählte Prozesse aus, um spezialisierte Expertise zu nutzen oder interne Ressourcen zu entlasten. Im Folgenden sind exemplarisch aufgezeigt, welche Prozessarten besonders häufig extern vergeben werden.
Entwicklung (teilweise ausgelagert)
Die Entwicklung von Medizinprodukten wird häufig ausgelagert, weil sie hochspezialisierte Expertise und moderne Technologien erfordern, die nicht jeder Hersteller intern vorhalten kann. Externe Entwicklungsdienstleister verfügen oft über langjährige Erfahrung, etablierte Prozesse und multidisziplinäre Teams, was die Produktentstehung effizienter und innovativer macht. Zudem ermöglicht Outsourcing eine flexible Skalierung der Ressourcen, insbesondere in frühen oder besonders komplexen Entwicklungsphasen. Zuletzt ist die Auslagerung einzelner Teilbereiche immer dann von Interesse, wenn eine spezifische Qualifikation oder Expertise von Nöten ist, die intern nicht aufgeboten werden kann (z.B. klinische oder biologische Bewertungen)
Klassische Fertigung
Die klassische Fertigung nach eigenen Spezifikationen wird ebenso oft ausgelagert, indem spezialisierte Auftragsfertiger genutzt werden, um Skalierbarkeit und Kostenvorteile zu gewinnen. Die Verantwortung über die Spezifikationen verbleibt beim Hersteller, während die operative Herstellung vollständig beim Lieferanten liegen kann, was eine strukturierte Kontrolle zwingend erforderlich macht.
Um die Produktqualität sicherzustellen, sind Maßnahmen wie Lieferantenqualifizierung, regelmäßige Audits, Prozessfähigkeitsanalysen und streng geregelte Abnahmeprüfungen sinnvoll. Zusätzlich unterstützen klare Qualitätsvereinbarungen (QSV/QAA) und ein risikobasierter Überwachungsplan die durchgängige Kontrolle. So lässt sich sicherstellen, dass der Auftragsfertiger jederzeit konform produziert und das Medizinprodukt den regulatorischen Anforderungen entspricht.
Montage- oder Teilprozesse
Die Montage oder auch Teilprozesse davon werden gerne ausgelagert, da sie spezialisierte Fertigungsschritte effizient und mit hoher technischer Expertise abdecken können. Dazu gehören etwa präzise Schweißprozesse wie Laser- oder Ultraschallschweißen, die besondere Maschinenkompetenz und klare Prozessparameter erfordern.
Auch Reinraumprozesse werden häufig extern durchgeführt, wenn sensible Komponenten unter kontrollierten Umgebungsbedingungen gefertigt oder montiert werden müssen. Ebenso zählen Bedruckungs- und Etikettierungsprozesse zu typischen ausgelagerten Tätigkeiten, da sie spezialisierte Anlagen und qualitätssichernde Technologien voraussetzen.
Für all diese Prozessarten gelten in der Regel spezifische Validierungsanforderungen – der Hersteller bleibt dafür verantwortlich und muss geeignete Maßnahmen wie Prozessfreigaben, Auditierungen der Lieferanten sowie eine kontinuierliche Überwachung der Prozessleistung sicherstellen.
Kritische ausgelagerte Prozesse, die besondere Anforderungen erfüllen müssen
Einige Tätigkeiten gelten als besonders kritisch, weil sie maßgeblich die Sicherheit des Medizinprodukts beeinflussen.
Sterilisation
Ausgelagerte Sterilisationsprozesse gehören zu den am strengsten regulierten Bereichen innerhalb der Medizinprodukteherstellung, da sie direkt die Sicherheit und Wirksamkeit des Produkts beeinflussen.
Ob Ethylenoxid-Sterilisation, Gammastrahlung oder Dampfsterilisation – Hersteller müssen sicherstellen, dass jeder Prozess vollständig validiert ist und den geltenden Normen entspricht. Dazu gehören umfangreiche mikrobiologische Kontrollen, die regelmäßig b
elegen müssen, dass die erforderliche Sterilität zuverlässig erreicht wird.
Darüber hinaus ist eine kontinuierliche Requalifizierung der Prozesse notwendig, um Veränderungen in Materialien, Chargen oder Anlagen sicher abzudecken. Ein robustes Lieferantenmanagement mit klaren Verantwortlichkeiten und dokumentierten Nachweisen ist dabei unerlässlich, um die regulatorischen Anforderungen dauerhaft zu erfüllen.
Laboruntersuchungen
Viele Hersteller lagern Laboruntersuchungen an externe Dienstleister aus, um Fachwissen und Kapazitäten effizient zu nutzen. Typische ausgelagerte Tätigkeiten sind beispielsweise Biokompatibilitätsprüfungen, mikrobiologische Tests, chemische Analysen und Materialprüfungen.
Dabei ist es entscheidend, dass die ausgewählten Labore qualifiziert sind und idealerweise nach ISO 17025 akkreditiert sind. Die ISO 17025 legt dabei Anforderungen an Kompetenz, Qualitätssicherung und Prüfverfahren fest, um verlässliche Ergebnisse zu gewährleisten.
Fehlt eine formale Akkreditierung, sollten zumindest angemessene Nachweise der fachlichen Kompetenz vorliegen. Eine sorgfältige Auswahl und regelmäßige Überprüfung der Labore sichert auch hier die Qualität der ausgelagerten Untersuchungen und minimiert Risiken für Hersteller und Endanwender.
Prüfung & Messung
Hersteller lagern zunehmend Prüf- und Messaufgaben an spezialisierte externe Dienstleister aus, um vor allem Fachkompetenz zu nutzen. Besonders kritische ausgelagerte Tätigkeiten sind EMV-Tests, elektrische Sicherheit nach IEC 60601, Software-Penetrierungstests sowie Transportvalidierungen.
Für solche Prüfungen ist es essenziell, dass die Labore oder Prüfdienstleister über nachweisbare Qualifikationen verfügen und geeignete Standards einhalten. Akkreditierungen, Normkonformität und regelmäßige Kompetenznachweise gewährleisten verlässliche Ergebnisse.
Mögliche ausgelagerte Prozesse über den gesamten Produktlebenszyklus
Die Möglichkeit ausgelagerter Prozesse betrifft nicht nur die Entwicklung und Fertigung, sondern kann sich über den gesamten Produktlebenszyklus erstrecken. Im Bereich After-Sales- und Service ist es denkbar Wartung, Reparaturen und Kalibrierservices an externe Dienstleister zu vergeben. Auch diese Anbieter müssen vollständig in das Qualitätsmanagementsystem des Herstellers integriert sein.
Auch Regulatory Affairs wird oft, wenn auch nur teilweise ausgelagert: Externe Experten bewerten neue regulatorische Anforderungen, erstellen globale Zulassungsdossiers und kommunizieren mit Behörden. Solche Tätigkeiten gelten nach ISO 13485 ebenfalls als ausgelagerte Prozesse und unterliegen entsprechenden Kontrollpflichten.
Im Bereich Distribution und Logistik übernehmen ausgelagerte Zentren Lagerung, Temperaturkontrolle, Verpackung und Versandabwicklung. Der Hersteller muss dabei die Rückverfolgbarkeit, lückenlose Dokumentation und die Kontrolle der Transportbedingungen sicherstellen
Lieferantenmanagement
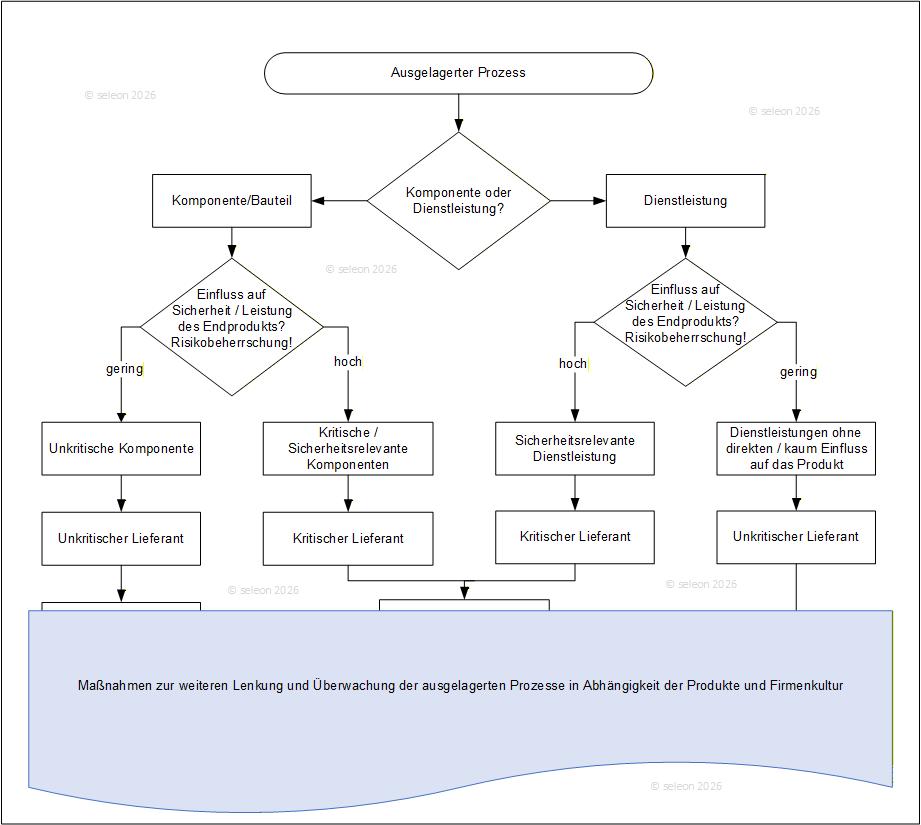
Abbildung 1 Lieferantenmanagement bei ausgelagerten Prozessen
Das Lieferantenmanagement ist ein zentraler Baustein zur Sicherstellung der Produktqualität, insbesondere wenn Prozesse oder Komponenten ausgelagert werden. Die ISO 13485 fordert, dass Hersteller ihre Lieferanten risikobasiert bewerten, qualifizieren und überwachen – besonders, wenn es sich um kritische oder sicherheitsrelevante Komponenten handelt.
Der Abschnitt 7.4 der ISO 13485 beschreibt die Anforderungen an ein strukturiertes und risikobasiertes Lieferantenmanagement. Hersteller müssen Lieferanten bewerten, auswählen, überwachen und regelmäßig neu bewerten, um sicherzustellen, dass eingekaufte Produkte und Dienstleistungen die definierten Anforderungen erfüllen. Zudem verlangt der Abschnitt klare und vollständige Beschaffungsangaben sowie geeignete Methoden zur Verifizierung eingekaufter Produkte.
Bei ausgelagerten Prozessen gilt der Dienstleister als Lieferant und muss vorab in Bezug auf deren Einfluss auf die Sicherheit des Produktes bewertet werden und in kritische und nicht-kritische Lieferanten kategorisiert werden. Kritische Lieferanten benötigen eine formale Qualifizierung, die oft Audits, Prozessanalysen und eine Überprüfung der Datenintegrität umfasst.
Für sicherheitsrelevante Bauteile verlangt das Risikomanagement zusätzlich eine Bewertung möglicher Ausfallmodi sowie geeignete Kontrollen entlang der Lieferkette. Vertragliche Vereinbarungen müssen Qualitätsanforderungen, Rückverfolgbarkeit, Meldewege und Pflichten bei Änderungen klar definieren. Leistungskennzahlen, regelmäßige Reviews und eine kontinuierliche Überwachung können hier sicherstellen, dass auch kritische Lieferanten dauerhaft zuverlässige Ergebnisse liefern.
Fazit: Ausgelagerte Prozesse gezielt steuern
Ausgelagerte Prozesse bieten enorme Vorteile – Flexibilität, Kosteneffizienz und Zugang zu spezialisierter Expertise. Allerdings bleibt die regulatorische Verantwortung immer beim Hersteller.
Die wichtigsten Erfolgsfaktoren hierfür sind:
- klare Spezifikationen
- systematische Lieferantenqualifikation
- Vertragsmanagement mit Qualitätsvereinbarungen
- Risikobewertung der ausgelagerten Tätigkeiten
- regelmäßige Überwachung und Audits
- lückenlose Dokumentation gemäß ISO 13485
Wer diese Bausteine in sein QMS integriert, schafft ein robustes System, das Qualität und Compliance über die gesamte Wertschöpfungskette gewährleistet – auch dann, wenn wesentliche Prozesse nicht im eigenen Haus stattfinden.
Gerne unterstützen wir Sie bei der Implementierung und Aufrechterhaltung eines erfolgreichen Lieferantenmanagements.
Bitte beachten Sie, dass alle Angaben und Auflistungen nicht den Anspruch der Vollständigkeit haben, ohne Gewähr sind und der reinen Information dienen.




