Hauptsache Symbole nach der aktuellen ISO 15223-1:2021? Nein, so einfach ist es nicht. Für die Anbringung der richtigen Symbole und Kennzeichen, sind auch der Anhang I der MDR/ IVDR und weitere Normen relevant. Nutzen Sie dieselben Etiketten international, gilt es auch immer, die Normenstände ganz genau zu beachten. Und worin liegt eigentlich der Unterschied zu einem Sicherheitskennzeichen? Wir räumen einmal auf und schaffen Ihnen einen Überblick über die wichtigsten Vorgaben für Symbole, Grafiken und Sicherheitskennzeichen auf Medizinprodukten und In-vitro-Diagnostika.
Warum ist es sinnvoll, Symbole auf den Produkten anzubringen?
Im ersten Anlauf könnte man an dieser Stelle dazu neigen, zu sagen, dass man ja MUSS. Und dies ist auch korrekt. Der Gesetzgeber sieht im Rahmen der Europäischen Verordnungen 2017/745 MDR und 2017/746 jeweils in Anhang I Kapitel III, vor, dass die vom Hersteller bereitgestellten Angaben unter Berücksichtigung der vorgesehenen Anwender in Form von international anerkannten Symbolen gemacht werden. „Gegebenenfalls verwendete Symbole oder Identifizierungsfarben entsprechen den harmonisierten Normen oder (Gemeinsamen) Spezifikationen. Gibt es keine derartigen harmonisierten Normen oder GS für den betreffenden Bereich, so werden die Symbole und Identifizierungsfarben in der beigegebenen Produktdokumentation erläutert.“ Unabhängig von dieser gesetzlichen Vorgabe gibt es auch gute Gründe, Symbole zu verwenden: Gerade die in der ISO 15223-1 „Medizinprodukte – Symbole zur Verwendung im Rahmen der vom Hersteller bereitzustellenden Informationen“ aufgezeigten Symbole sind international anerkannt und sorgen für ein gleiches Verständnis der Produkteigenschaften und -Handhabung auf. Übersetzungskosten können eingespart und -fehler vermieden werden, außerdem bleibt so auch mehr Platz auf dem Produkt und im Lager, da weniger Sprachvarianten erzeugt und vorrätig gehalten werden müssen.
Regulatorisches Wissen zu Symbolen
In Europa kommt wie bereits erwähnt Anhang I Kapitel III der beiden Verordnungen zum Tragen, wenn es um Symbole auf den Medizinprodukten kommt. Hierbei ist nochmal hervorzuheben, dass die Symbole den harmonisierten Normen für Symbole zu entsprechen haben, nicht können oder sollten. Hier ist also zwingend die harmonisierte Norm anzuwenden, und keine ältere oder neuere. Aktuell ist dies die “EN ISO 15223-1:2021 Medical devices – Symbols to be used with information to be supplied by the manufacturer – Part 1: General requirements (ISO 15223-1:2021)”. Spannend wird es jedoch, wenn auch andere harmonisierte Normen Symbole (oder Sicherheitskennzeichen) vorgeben, die jedoch denen der EN ISO 15223-1 wiedersprechen. Noch ist die IEC 60601-1 nicht unter der MDR harmonisiert, ist aber ein interessantes Beispiel für dieses Thema, auf welches wir im nächsten Abschnitt näher eingehen.
Für die regulatorischen Anforderungen an Symbole lohnt sich jedoch auch der Blick außerhalb der EU. So verlangt die brasilianische RDC 751/2022 für Medizinprodukte ebenfalls:
VI – Die Informationen können gegebenenfalls in Form von Symbolen oder Farben dargestellt werden, die den geltenden Vorschriften oder technischen Normen entsprechen müssen;
VII – Wenn es keine Vorschrift gibt, müssen die Symbole und Farben in der Bedienungsanleitung beschrieben werden.
Im Rahmen der brasilianischen RDC 830/2023 für IVDs wird explizit die Verwendung der ABNT NBR ISO 15223 eingefordert:
VII – Die Symbole auf Produkten, die für Laien bestimmt sind, müssen mit einer Legende versehen sein;
VIII – die Verwendung anderer Symbole, die nicht in der Norm ABNT NBR ISO 15223 vorgesehen sind, ist auf Produkten, die für den professionellen Gebrauch bestimmt sind, zulässig, sofern sie von einer Legende begleitet werden;
Neben der jeweiligen nationalen ISO15223-1 Norm sollten jedoch auch unbedingt weitere Normen berücksichtigt werden, insbesondere, wenn es um zusätzliche Symbole oder die Eigenkreation von Symbolen geht. Diese sind wie folgt:
- ISO 15223-2: Medical devices – Symbols to be used with medical device labels, labelling, and information to be supplied – Part 2: Symbol development, selection and validation à aktuell im ISO Committee in Überarbeitung
- ISO 20417: Medical devices – Information to be supplied by the manufacturer
- ISO 7000: Graphical symbols for use on equipment
- ISO 7010 Graphical symbols – Safety colours and safety signs – Registered safety signs
- ISO 3864-1:2011 Graphical symbols – Safety colours and safety signs – Part 1: Design principles for safety signs and safety markings
Die Versionen ISO 20417:2021, ISO 7000:2019 und ISO 7010:2019 werden von der amerikanischen FDA vollumfänglich als recognized standards anerkannt. Dies ist wichtig, da nur Symbole, die von internationalen Normungsgremien erarbeitet und durch die FDA anerkannt wurde, das Symbol nicht von einer nebenstehenden Erläuterung begleitet werden muss, sondern „lediglich“ im „Symbols Glossary“ erläutert werden sollte.
Der Unterschied zwischen Symbol und Sicherheitszeichen
Symbole sind grafische Darstellungen auf dem Etikett und/oder der Begleitdokumentation eines Produkts, die charakteristische Informationen vermittelt, ohne dass der Lieferant oder Empfänger der Informationen bestimmte Sprachkenntnisse beherrschen muss.
Sicherheitszeichen sind Zeichen, die mittels Farben, Formen und Symbolen einen besonderen Sicherheitshinweis vermitteln. Ein Sicherheitszeichen muss in Form und Farbe der ISO 7010 entsprechen.
Symbole kommunizieren Informationen an verschiedenen Berührungspunkten mit dem Medizinprodukt (z.B. während des Transports, der Lagerung, dem Verkauf, der Anwendung bis hin zur Entsorgung) und es werden Restrisiken bezüglich des Medizinprodukts mitgeteilt. Im Gegensatz dazu dienen Sicherheitszeichen zur Übermittlung einer Warnung, eines Verbots oder eines Gebots zur Minderung eines Risikos. Ihr Stellenwert ist also in der Risikominderung höher als der eines Symbols, jedoch muss der Minderungseffekt auch gut belegt sein.
Kombiniert man die Symbole der EN ISO 15223-1 mit den Vorgaben der ISO 7010 kann somit auch aus einem Symbol ein Sicherheitskennzeichen werden, das jedoch nicht als solches genormt ist.
Schwierig wird die Entscheidungsfindung, wenn jedoch zu einem Thema zwei, drei oder gar vier Symbole / Sicherheitszeichen existieren. Hier sollte die Auswahl entsprechend mit Bedacht getroffen und begründet sein:

Bei der Auswahl sollte in jedem Fall der Normentext der IEC 60601-1 Abschnitt 7.2.3 „Einsichtnahme in die BEGLEITPAPIERE“ berücksichtigt werden:
Wenn der HERSTELLER die Einsichtnahme in die BEGLEITPAPIERE als eine primäre Maßnahme der RISIKOBEHERRSCHUNG für ein bestimmtes RISIKO anwendet […] und der PROZESS der GEBRAUCHSTAUGLICHSKEITSORIENTIERTEN ENTWICKLUNG […] bestimmt, dass die Kennzeichnung des ME-GERÄTS für die Wirksamkeit der RISIKOBEHERRSCHUNG erforderlich ist, muss das ME-GERÄT mit dem Gebotszeichen ISO 7010-M002, „Anleitung beachten“, gekennzeichnet werden […].
Andernfalls darf das Bildzeichen ISO 7000-1641 […] verwendet werden, um dem BEDIENER den Aufbewahrungsort der Gebrauchsanweisung mitzuteilen oder zu empfehlen,
die BEGLEITPAPIERE einzusehen
Dies ist ein Beispiel für die risikobasierte Abwägung, wann ein Symbol und wann ein Sicherheitszeichen zum Einsatz kommen können.
Welche Symbole sind mit der aktuellen Version der EN ISO 15223-1:2021 hinzugekommen?
Im Folgenden möchten wir Ihnen einen kurzen Überblick über einige neue Symbole geben, die in der neuesten Version der Norm enthalten sind. Diese Liste ist jedoch nicht erschöpfend. In jedem Fall gilt es vor Umsetzung der MDR oder IVDR die Aktualität und Vollständigkeit der verwendeten Symbole mit der unter der MDR/IVDR harmonisierten Ausgabe abzuprüfen.
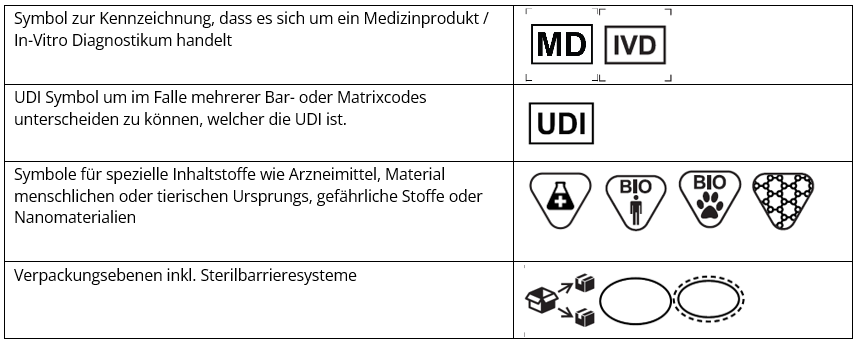
Typische Fragestellungen rundum das Thema Symbole
Wie kann ich sicherstellen, dass alle erforderlichen Symbole und Informationen auf dem Medizinprodukt angebracht sind?
MDR Anhang I, Kapitel III beschreibt Anforderungen an Kennzeichnung und Gebrauchsanweisung, Abschnitt 23.2 listet die Anforderungen an die Kennzeichnung und Abschnitt 23.3. Angaben auf der Sterilverpackung auf.
Weitere Anforderungen an vom Hersteller bereitzustellende Informationen stellt DIN EN ISO 20417. Je nach dem Produkt gibt es produktspezifische Normen die auch einige Anforderungen an Kennzeichnung stellen, daher sind die Hersteller gefragt sich im Einzelnen mit den Anforderungen auseinander zu setzen. Die Erstellung einer Kennzeichnungs-Checkliste, in der die Informationen mit den entsprechenden Symbolen abgebildet und zugeordnet sind, kann hier eine Hilfe sein. Die Risikoanalyse und einen Risikoexperten in die Planung und Auswahl der Symbole mit einzubeziehen ist ratsam, da wichtige Sicherheitsinformationen in der Risikoanalyse festgehalten werden.
Sind die Medizinprodukte für den US-Markt bestimmt ist ein Blick in die FDA Anforderungen 21 CFR Part 801 sowie weitere detaillierte Guidances und Produktanforderungen erforderlich.
Wo sind die erforderlichen Symbole und Informationen anzubringen?
Kennzeichnung (engl. Labeling) bezieht sich sowohl auf ein Etikett oder Direktmarkierung auf dem Medizinprodukt und seiner Verpackung als auch die Gebrauchsanweisung und andere vom Hersteller bereitgestellte Informationen für Anwender und/oder Patienten. Die Kennzeichnung umfasst schriftliche und grafische Informationen, wobei die Bedeutung der grafischen Informationen erklärt werden müssen.
Wie stelle ich sicher, dass die bereitgestellten Informationen gelesen und verstanden werden?
Die DIN EN ISO 20417 fordert, dass die vom Hersteller bereitzustellenden Informationen in Worten verfasst und dargestellt werden müssen, die von den vorgesehenen Anwendern leicht verstanden werden. In anderen Worten: Hersteller müssen sich genau überlegen, wer der Anwender ist, ein Laie oder doch ein Benutzer mit speziellen medizinischen Kenntnissen? Durch die Verwendung standardisierter Symbole bei der Kennzeichnung können die Hersteller den Anwendern wichtige Informationen effektiv vermitteln und das Risiko von Fehlern oder Missverständnissen verringern. Allerdings werden die Anwender unter Umständen nicht alle Symbole sofort kennen, daher ist es wichtig alle graphischen Informationen, die Text ersetzen, wie z.B. Piktogramme, Symbole, Sicherheitszeichen und sicherheitsbezogene Identifizierungsfarben zu erläutern.
In welcher Schriftgröße müssen die Informationen aufgebracht werden?
Ein hehrer Wunsch, der jedoch nicht einfach mit „Ja, nehmen Sie Größe 6“ beantwortet werden kann.
In Australien sieht Essential Principle 13.1((5) eine Mindesthöhe von einem Millimeter vor. Die südkoreanische „Regulation on labeling and description of medical devices“ sieht mind. Schriftgröße 6 (Professionelle Anwender) bzw. Schriftgröße 7 (Produkte für Laien) vor.
In Europa und weiteren MDSAP Mitgliedsländern wie Kanada ist jedoch keine konkrete Vorgabe definiert, jedoch existieren ähnliche Vorgaben, dass die Größe der Informationen so gewählt sein muss, dass sie lesbar und verständlich ist und über die gesamte Lebensdauer des Produktes vorhanden bleibt .Hier kommen als das Risikomanagement, die Usability und Lebensdauer/Verpackungstests ins Spiel.
Bei der Ausgestaltung der Informationen – also Etiketten und Gebrauchsanweisung – gibt es viele wichtige Inhalte zu beachten und miteinander zu verknüpfen. Insbesondere um Symbole korrekt einzusetzen und von ihren Vorteilen zu profitieren zu können, nämlich der Möglichkeit Platz zu sparen durch weniger Übersetzungen und somit kleiner Verpackungen zu ermöglichen. Aber auch um Handhabungshinweise korrekt zu kommunizieren und fehlerhafte Anwendungen zu minimieren. Gerne unterstützen wir Sie bei der Konzipierung Ihrer MDR konformen Kennzeichnung!
Bitte beachten Sie, dass alle Angaben und Auflistungen nicht den Anspruch der Vollständigkeit haben, ohne Gewähr sind und der reinen Information dienen.




